Aufbau-princippet er den grundlæggende metode, der fortæller os, hvordan elektronerne fyldes i atombanen. Ifølge Aufbau-princippet følger fyldningen af elektronerne i et atoms grundtilstand et grundlæggende mønster. Dette princip fortæller os, at elektronerne i ethvert atoms atombane er fyldt i den stigende rækkefølge af deres energi, og for at finde energien i atombanen følger de n+l-reglen.
Strukturprincip
I denne artikel vil vi lære om Aufbau-princippet, funktioner i Aufbau-princippet, dets undtagelser og begrænsninger i detaljer.
Definition af strukturprincip
Aufbaus princip siger det
Elektroner i forskellige orbitaler fyldes i stigende rækkefølge af deres energi, dvs. orbitalen med den laveste energi fyldes først og orbitalen med den højeste energi fyldes sidst.
Ordet 'Aufbau' på tysk betyder 'Opbygning'. Dannelse af orbitaler betyder at fylde orbitaler med elektroner. Den siger, at elektronerne i atomorbitaler er fyldt i den stigende rækkefølge af energien i atomorbitalen. Og energien af atomorbitalen beregnes ved hjælp af n+l-reglen, der siger, om elektronen med et højere tal af n+l-værdien har den højere energi. I reglen diskuteret i den foregående linje, n fortæller Principal Quantum nummer og l fortæller Azimuthal Quantum nummer.
Hvis to elektroner har samme værdi af n+l, så er elektronen med en mindre værdi på n har den mindre energi og fyldes først. Rækkefølgen af at fylde elektronerne i en atomorbital er diskuteret nedenfor.
Principdiagrammets opbygning
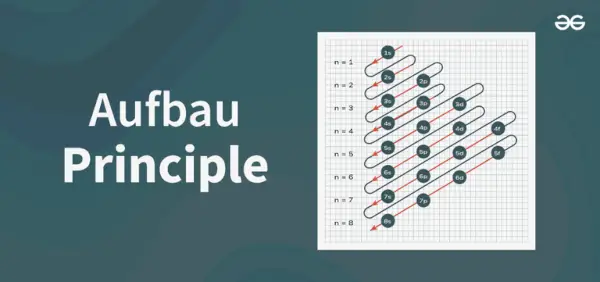
Aufbau-principdiagrammet er diagrammet, der viser rækkefølgen af at fylde elektronerne i et atom.
Principdiagrammets opbygning
Principformlens opbygning
Aufbau-principformlen er formlen, der fortæller den rækkefølge, hvori elektronerne er fyldt i atomkredsløbet. Atomorbitalformlen er
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p…….
Principstruktur Klasse 11
Aufbau-princippet er et vigtigt princip i kemi for eleverne i klasse 11. Dette princip siger, at,
Elektronerne i atomkredsløbet af et atom er udfyldt i stigende rækkefølge af energien i atomkredsløbet, der beregnes ved hjælp af (n+l)-reglen.
Tegning af strukturdiagrammet
Aufbau Diagram er tegnet ved hjælp af trinene tilføjet nedenfor,
- Find antallet af elektroner, der skal fyldes i atomerne.
- Vi ved, at i et atom
- s-orbital kan maksimalt rumme 2 elektroner.
- p-orbital kan maksimalt rumme 6 elektroner.
- d-orbital kan maksimalt rumme 10 elektroner.
- f-orbital kan maksimalt rumme 14 elektroner.
- Udfyld de to første elektroner i 1s orbitalen.
- Følg derefter n+l-reglen og fyld derefter elektronerne i overensstemmelse hermed.
Fremtrædende træk ved strukturprincippet
Forskellige funktioner i Aufbau-princippet er,
- Energien af en orbital afhænger af summen af værdierne af det primære kvantetal (n) og det azimutale sumtal (I). Dette kaldes (n + l) regel . Ifølge denne regel,
- I et neutralt isoleret atom, jo lavere værdien af (n + l) for en orbital er, jo lavere er energien. Men hvis to forskellige typer orbitaler har samme værdi (n + l), så har orbitaler med en lavere værdi på n mindre energi.
| Type orbital | Værdi af n | Værdien af l | Værdi af n+l | Relativ energi |
|---|---|---|---|---|
| 1s | 1 | 0 | 1+0 = 1 | Laveste energi |
| 2s | 2 | 0 | 2+0 = 2 | Højere energi end 1s orbital |
| 2 p 3s | 2 3 | 1 0 | 2+1 = 3 3+0 = 3 | 2p orbitaler(n=2) har lavere energi end 3s(n=3) orbitaler. |
| 3 s 4s | 3 4 | 1 0 | 3+1 = 4 4+0 = 4 | 3p orbitaler(n=3) har lavere energi end 4s(n=4) orbitaler. |
| 3d 4 p | 3 4 | 2 1 | 3+2 = 5 4+1 = 5 | 3d orbitaler(n=3) har lavere energi end 4p(n=4) orbitaler. |
Af beskrivelsen givet i tabellen følger det, at energierne af de forskellige orbitaler stiger med stigningen i antallet af hovedkvantetallet.
- Således rækkefølgen, hvori elektronerne er fyldt i atombanen af atom er, 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p...
Elektronisk konfiguration ved hjælp af Aufbau-princippet
Det elektronisk konfiguration Brug af Aufbau-princippet til nogle få elementer diskuteres nedenfor:
Elektronkonfiguration af svovl
Atom nummer svovl er 16, dvs. det har 16 elektroner
Nu ved at bruge Aufbau-princippet skrives den elektroniske konfiguration af svovlen som,
[S] = 1 sek 2 2s 2 2 p 6 3s 2 3 s 4
10 af 10
Elektronkonfiguration af nitrogen
Atomnummer af nitrogen er 7, dvs. det har 7 elektroner
Nu ved at bruge Aufbau-princippet skrives den elektroniske konfiguration af nitrogenet som,
[N] = 1 sek 2 2s 2 2 p 3
Undtagelser fra konstruktionsprincippet
Der er nogle få undtagelser fra Aufbau-princippet, som er krom og kobber. Deres elektroniske konfiguration er,
Elektronisk konfiguration af Chromium
Den elektroniske konfiguration af Chromium i henhold til Aufbau-princippet bør være
- Cr(24): [Ar]3d 4 4s 2
Men ovenstående konfiguration er ikke korrekt, fordi den faktiske elektroniske konfiguration af Chromium(Cr) er,
- Cr(24): [Ar]3d 5 4s 1
Årsagen til denne elektroniske konfiguration er, at halvfyldt d-atomorbital er mere stabil end orbitalen fyldt i henhold til Aufbau-princippet.
Elektronisk konfiguration af kobber
Den elektroniske konfiguration af kobber i henhold til Aufbau-princippet bør være,
- Cu(29): [Ar]3d 9 4s 2
Ovenstående konfiguration er ikke korrekt, fordi den faktiske elektroniske konfiguration af kobber(Cu) er,
- Cu(29): [Ar]3d 10 4s 1
Årsagen til denne elektroniske konfiguration er, at fuldt udfyldt d-atomorbital er mere stabil end orbitalen fyldt i henhold til Aufbau-princippet.
Læs mere
- Kvantetal
- Atomorbitalers form
- Atomstruktur
Strukturprincip – ofte stillede spørgsmål
Hvad er Aufbau-princippet i kemi?
Aufbau-princippet i kemi er det grundlæggende princip, der bruges til at fylde elektronerne i ethvert atoms atomare orbitaler. Denne sætning fortæller os i hvilken rækkefølge elektronerne er fyldt i atombanen.
Hvem gav Aufbau-princippet?
Aufbau-princippet blev givet af den berømte danske fysiker Niels Bohr i 1920.
Hvad er Paulis udelukkelsesprincip?
Paulis udelukkelsesprincip siger, at i et atom ikke to elektroner har alle fire kvantetal t han samme. I det mindste er et af kvantetallet forskelligt for alle elektroner i atomet.
Hvad er n+l-reglen?
n+l-reglen er reglen, der angiver, at energien af en orbital afhænger af summen af hovedkvantetal(n) og det azimutale kvantetal(l). denne regel kaldes (n+l) reglen.
Hvad er undtagelserne fra Aufbau-princippet?
Undtagelsen fra Aufbau-princippet er,
- Elektronisk konfiguration af Chromium Cr[24]
- Elektronisk konfiguration af kobber Cu[29]
