Atomiske orbitaler , som er matematiske funktioner, beskriver bølgeadfærden af elektroner (eller elektronpar) i et atom. Atomorbitaler har forskellige former alt efter deres type. De forskellige former for atomare orbitaler beskriver, at der enten er den højeste eller nul sandsynlighed for at finde en elektron omkring kernen i nogle retninger. Der er fire typer orbitaler, hver med en forskellig form og repræsenteret af bogstaverne s, p, d og f. Der tages hensyn til s- og p-orbitaler, fordi de er de mest udbredte i kemisk og biologisk kemi. An s-orbital har en sfærisk kerne i midten, en p-orbital er håndvægtsformet, og fire af de fem d orbitaler er kløverbladsformede. Den femte d orbital er formet som en lang håndvægt med en donut i midten. Et atoms orbitaler er organiseret i lag eller elektronskaller.
Hvad er atomorbitaler?
Atomorbitaler er det tredimensionelle rum nær kernen af et atom, hvor muligheden for at opdage en elektron er maksimal.
Et atom kan ifølge kvanteatommodellen have et uendeligt antal orbitaler. Disse orbitaler kan klassificeres baseret på deres størrelse, form eller orientering. En smallere orbital betyder, at der er en bedre sandsynlighed for at fange en elektron tæt på kernen. Orbitalbølgefunktionen er ofte kendt som en matematisk funktion, der bruges til at udtrykke koordinaterne for en elektron. Sandsynligheden for at lokalisere en elektron er repræsenteret ved kvadratet af orbitalbølgefunktionen. Denne bølgefunktion hjælper også med at skabe grænseoverfladediagrammer.
Orbital bølgefunktion
Det kvante atommodel forudsiger, at et atom kan have et stort udvalg af orbitaler. Disse orbitaler kan grupperes efter deres størrelse, geometri eller hældning. En reduceret orbitalstørrelse øger sandsynligheden for at opnå en elektron tæt på kernen. Den matematiske funktion, der bruges til at repræsentere en elektrons koordinater, kaldes orbital bølge funktion . Sandsynligheden for at opdage en elektron er repræsenteret ved kvadratet af orbitalbølgefunktionen.
Vi kan også bruge denne bølgefunktion til at skabe grænseoverfladediagrammer. Vi kan bedre forstå formen af orbitaler ved at bruge grænseoverfladediagrammer af den konstante sandsynlighedstæthed for forskellige orbitaler.
test og typer af test
Former af atomare orbitaler
De atomare orbitalers former varierer. Det vil sige, at sandsynlighedsfordelingerne af de elektroner, de beskriver omkring kernen, er forskellige. Det faktum, at elektronerne i forskellige orbitaler sandsynligvis er placeret i forskellige områder omkring moderkernen og dermed oplever sidstnævntes tiltrækning med forskellige styrker, er en af grundene til, at orbitaler varierer i energi. Det er forbløffende, at alle orbitaler i en given skal af brintatomet har den samme energi, mens de har forskellige former. Dette skyldes eliminering af forskellige energirelaterede bidrag.
Men så snart der er en anden elektron, forsvinder degenerationen.
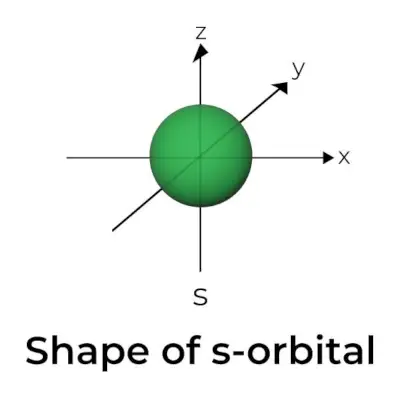
Form af s-orbital
- Det s orbitale grænseoverfladediagram ligner en kugle med kernen i centrum, som kan vises i to dimensioner som en cirkel.
- s-orbitaler er sfærisk symmetriske, hvilket betyder, at sandsynligheden for at finde en elektron i en given afstand er den samme i alle retninger.
- Størrelsen af s orbitalen er ligeledes vist at stige, når værdien af det primære kvantetal (n) stiger; derfor 4s> 3s> 2s> 1s.
- Knudepunktet er et sted, hvor der ikke er nogen chance for at lokalisere elektronen. Noder er klassificeret i to typer: radiale noder og vinkelknuder. Afstanden fra kernen beregnes af de radiale knuder, mens orienteringen bestemmes af vinkelknuderne.
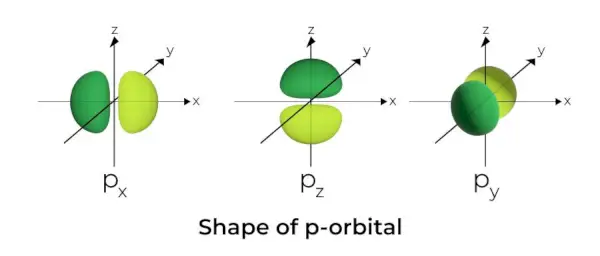
Form af p-Orbital
- P-orbitalerne er dannet som håndvægte.
- Den p orbitale knude er placeret i kernens centrum.
- På grund af tilstedeværelsen af tre orbitaler kan p-orbitalen maksimalt optage seks elektroner.
- Hver p-orbital består af to dele kendt som lapper, der er placeret på hver side af det plan, der løber på tværs af kernen.
- Hver p orbital har dele kendt som lapper på hver side af planet, der løber på tværs af kernen. I det plan, hvor de to lapper skærer hinanden, er sandsynligheden for at finde en elektron nul.
- De tre orbitaler er kendt som degenererede orbitaler, fordi de har samme størrelse, form og energi.
- Den eneste forskel mellem orbitalerne er orienteringen af lapperne. Fordi lapperne er orienteret langs x-, y- eller z-aksen, får de navnene 2px, 2py, og 2pz. Formlen n –2 bruges til at beregne antallet af noder.
- På samme måde som s-orbitaler stiger størrelsen og energien af p-orbitaler, når det primære kvantetal stiger (4p> 3p> 2p).
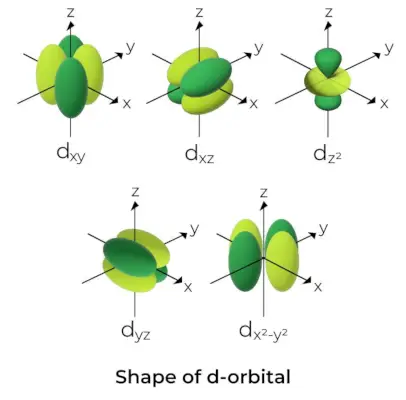
Form af d-Orbital
- For d orbitaler er det magnetiske orbitale kvantetal angivet som (-2,-1,0, 1,2). Som et resultat kan vi hævde, at der er fem d-orbitaler.
- Disse orbitaler er angivet med symbolerne dxy, dyz, dxz, dx2-og2og dMed2.
- Formerne af de første fire d orbitaler ligner hinanden, hvilket adskiller sig fra dMed2orbitaler, men energien af alle fem d orbitaler er den samme.
Form af f-Orbital
- Formen af f orbital er spredt. Fordi værdien af l=3 for f orbital, er den minimale værdi af det primære kvantetal n 4.
- De ækvivalente ml-værdier for f orbital er (-3,–2, –1, 0, +1, +2, +3).
- Som et resultat er der syv f orbitaler for l = 3.

10 af 50,00
Degenererede orbitaler
Degenererede orbitaler er dem med samme energi. Disse orbitaler er forskellige (de kan være orienteret forskelligt i rummet omkring atomkerne ), men de har den samme energi. I nærvær af et eksternt felt er degenerationen af p-orbital upåvirket; dog kan degenerationen af f- og d-orbitaler brydes ved at påføre systemet et eksternt felt (enten elektrisk eller magnetisk felt).
Få orbitaler vil have højere energi, mens andre vil have lavere energi. Degeneration vil ikke længere eksistere i systemet. For eksempel består d orbitaler af fem degenererede orbitaler, der alle har den samme energi.
Læs mere:
- Molekylær orbital teori
- Fyldning af orbital i et atom
- Hybridisering
Ofte stillede spørgsmål om former for atomorbitaler
Spørgsmål 1: Hvordan fungerer orbitaler?
Svar:
En atomorbital er et matematisk udtryk, der udtrykker den bølgelignende opførsel af en elektron eller et elektronpar i et atom i atomteori og kvantemekanik. Hver orbital vil maksimalt optage to elektroner, hver med sin egen mængde spin.
Spørgsmål 2: Hvad er Nodal Plane?
kompatibilitetstest
Svar:
Planet, hvor sandsynligheden for at finde en elektron er ubetydelig eller nul, kaldes Nodalplanet.
Spørgsmål 3: Hvor mange orbitaler er der?
Svar:
Fordi s-underniveauet kun har én orbital, kan kun to elektroner være til stede. Fordi p-underniveauet omfatter tre orbitaler, kan der maksimalt være seks elektroner til stede. Fordi d-underniveauet omfatter 5 orbitaler, kan der maksimalt være 10 elektroner til stede. Og hvert af de fire underniveauer har syv orbitaler, der maksimalt kan rumme 14 elektroner.
Spørgsmål 4: Hvilke orbitaler har den højeste energi?
java arraylist sorteret
Svar:
10 ml til ounces
Orbital 1'erne har mest energi. En elektrons energi er den mængde energi, der kræves for at få den ud af atomets elektriske boble.
Spørgsmål 5: Hvad er forskellen mellem en skal og en orbital?
Svar:
I et atom er en skal en samling af underskaller af samme kvantetalteori, n. Orbitaler har hver to elektroner, og elektroner i samme orbital har samme definition af størrelse, vinkelmomentstørrelse og magnetisk kvantetal.
Spørgsmål 6: Hvad er sigma- og pi-bindingen?
Svar:
Atomisk orbital overlapning skaber sigma- og pi-bindinger. Sigma-bindinger skabes af overlappende atomare orbitallapper, hvorimod Pi-bindinger genereres, når en atomorbitallappe overlapper en anden.
