Base er en kemisk forbindelse, der består af OH–ioner og accepterer protoner. Base i kemi er de forbindelser, der bliver rød lakmusblå, og når de reageres med syre, neutraliserer de reaktionen for at give salt og vand. Basens pH-værdi er større end 7. Baser er bitre i smagen og glatte i berøring. De baser, der er opløselige i vand, kaldes alkalier. Eksempler på baser er metaloxider, metalhydroxider osv. Sæbe er et eksempel på en base som vi bruger i dagligdagen. I denne artikel vil vi lære om definitionen, egenskaberne og kemiske reaktioner af baser i detaljer.

Grunddefinition
Base er defineret som den kemiske forbindelse, hvis pH-værdi er større end 7, accepterer en proton, neutraliserer syre og gør rød lakmus til blå. De befrier generelt OH–ion på dissociation. Eksempler inkluderer NaOH, NaHCO3,osv. Følgende er nogle generelle funktioner, der vises af basen:
- De har en bitter smag
- De er glatte i kontakt
- De bliver rød lakmusblå
- De befrier OH–ion, når den er opløst i vand
- De leder elektricitet i opløsningsform
Baser er en af de vigtigste kemiske forbindelser, der bruges i hverdagen. Baser bruges som antacida til at kontrollere surhedsgraden og i tandpasta for at neutralisere den bakterielle virkning, der producerer syre i vores mund og forhindrer nedbrydning af emalje og hulrum. De bruges også som bagepulver, bagepulver og vaskepulver.
Lewis Base
Lewis-baser er de forbindelser, der har elektronpar, og de kan donere det til de forbindelser, der mangler elektronpar. Lewis-baser er nukleofile i naturen, dvs. de er kerne-elskende, hvilket betyder, at de vil angribe et positivt ladet center med deres elektronpar. Eksempler på Lewis Base inkluderer Ammoniak, fordi i Ammoniak (NH3) centeratomet nitrogen har 5 elektroner, hvoraf 3 bruges til at lave bindinger med 3 hydrogenatomer og et par elektroner forbliver tilbage med N-atomet, hvilket gør NH3en Lewis-base.
Arrhenius Base
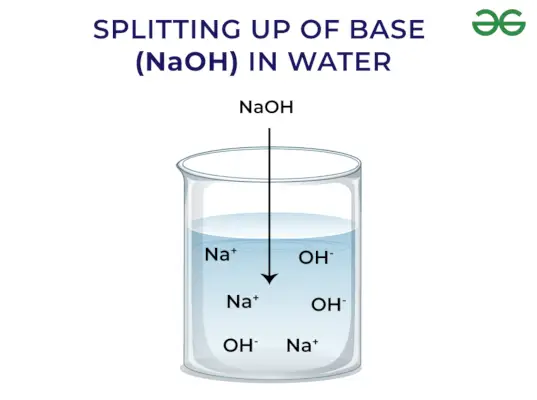
Ifølge Arrhenius's koncept er baser forbindelser, der frigiver hydroxidioner, når de opløses i vand og øger koncentrationen af hydroxylioner i den vandige opløsning. For eksempel, når KOH er opløst i vand, vil det give OH–ion og dermed øge koncentrationen af OH–i vandet.
Bronsted Base
Bronsted Concept of Base er en avanceret version af Arrhenius’ Concept, som siger, at baser er forbindelser, der accepterer H+ion eller proton for at danne deres konjugerede syre. For eksempel Cl–er en base, der accepterer H+at danne HCl som dets konjugerede syre.
Typer af baser
Baser kan klassificeres på basis af surhedsgrad, koncentration og ioniseringsevne. Klassifikationen er nævnt nedenfor
Typer af baser baseret på surhed
Surhed af en base refererer til antallet af udskiftelige hydroxylgrupper, der er til stede i et molekyle af basen. Baseret på surhedsgrad er baser klassificeret i tre kategorier:
- Monosyre base
- Disyrebase
- Triacidisk base
Monosyre: Mono-sure baser er dem, der kun indeholder én udskiftelig hydroxylion og interagerer med kun én hydrogenion. Monosyrebaser omfatter NaOH, KOH og andre.
Disyre: Disyrebase er en base med to udskiftelige hydroxylioner, der interagerer med to hydrogenioner. Ca(OH)2, Mg(OH)2, og andre di-sure baser er eksempler.
Trisyre: Trisyrebase er en type base, der omfatter tre udskiftelige hydroxylioner og tre hydrogenioner. Trisyrebaser inkluderer Al(OH)3, Fe(OH)3, og andre.
Typer af baser baseret på deres koncentration i vandig opløsning
Koncentration refererer til mængden af basen til stede i en vandig opløsning. Baseret på deres koncentration i vandig opløsning er baser opdelt i to kategorier:
- Koncentreret base
- Fortyndet base
Koncentreret base: Koncentrerede baser er dem, hvor mængden af base er stor sammenlignet med opløsningsmidlet. Koncentreret NaOH-opløsning, for eksempel.
Fortyndet base: Disse typer baser har en lavere koncentration af base i deres vandige opløsning. Fortynding er processen med at reducere procentdelen af et opløst stof ved at tilsætte mere mængde opløsningsmiddel. For eksempel fortynd NaOH, fortynd KOH og så videre.
Typer af baser baseret på ioniseringsgrad
Ioniseringsgrad refererer til en kemisk forbindelses evne til at frigive deres bestanddele, når den er opløst i vand. I tilfælde af Base refererer graden af ionisering til basens evne til at frigive OH–ioner, når de er opløst i vand. Baseret på graden af ionisering klassificeres baser i to typer:
- Stærk base
- Svag base
Stærk base: Stærke baser er de baser, der dissocierer fuldstændigt og frigiver OH-ion, når de opløses i vand. Nogle eksempler på stærke baser inkluderer NaOH, KOH osv.
Svag base: De baser, der ikke gennemgår fuldstændig dissociation og kun frigiver en brøkdel af OH-ion, kaldes svag base. Eksempler på svage baser inkluderer Al(OH)3,Cu(OH)2,etc.
Lær mere, Stærke og svage baser
Basers egenskaber
Da vi ved, at baser er kemiske forbindelser, der har OH-ion, bliver rød lakmusblå osv. I dette afsnit vil vi lære om basernes fysiske og kemiske egenskaber sammen med en kort viden om deres generelle egenskaber.
Basens generelle egenskaber
De generelle egenskaber for baser er nævnt nedenfor:
- En hydroxidion (OH–) frigives til vandet af baser. Jo stærkere basen bliver, efterhånden som flere ioner frigives.
- Baser reagerer med syre for at danne salt Syrer reagerer med baser. Denne reaktion af en base med syre kaldes en neutraliseringsreaktion.
- Baser bliver rød lakmus til blå.
- Et proteins struktur kan ændres af baser. Baser har denne kvalitet, som får dem til at føles glatte. Sæbe er en base, der bliver utrolig glat på din hud, når den er våd. På grund af deres evne til at ændre strukturen af proteiner er nogle kraftige baser ekstremt farlige.
Basers fysiske egenskaber
Baser smager bittert: Baser er bitre i smagen. På grund af dens bitterhed har vi kun få basiske fødevarer. Der er kun få alkaliske fødevarematerialer. Baser skal smages med mere forsigtighed sammenlignet med syrer.
Baser er glatte i berøring: Ved berøring føles baserne glatte. For eksempel sæbe.
Baser frigiver OH – Ion: Når baser opløses i vand, frigiver de hydroxylion (OH–). Afhængigt af evnen til at frigøre hydroxylioner klassificeres de som stærke og svage.
Baser neutraliserer syrer: Når baser reagerer med syrer, neutraliserer de hinanden og producerer salt og vand. Denne reaktion kaldes Neutraliseringsreaktion . Lad os sige, at vi har syren HY og basen 'XOH', så vil det dannede salt være 'XY'. Ligningen for denne reaktion kan gives som HY + XOH → HOH + XY.
Baser Denature Protein: Denaturering af protein betyder ødelæggelse af proteinets stabilitet og struktur. Dette gør brugen af base skadelig for mennesker, da menneskelig hud og hår består af protein, og når stærke alkalier såsom natrium- eller kaliumhydroxid også kaldet Lud bruges, skaber de en skadelig indvirkning på menneskelig hud.
Baser bliver rød lakmus til blå: Når baser bringes i kontakt med rød lakmus, bliver den blå. Det skal dog bemærkes, at en sådan ændring ikke kan observeres, når vi forsøger at reagere tør base med rødt lakmuspapir. Lakmuspapir-testen er en af de ældste metoder til at teste base. Der findes dog også andre indikatorer såsom phenolphtalein
Baser leder elektricitet: Når baser er i opløsningsform, har de mobil OH-ion, så de kan lede elektricitet.
Basers kemiske egenskaber
- Reaktion af base med metaller: Når alkali (base) reagerer med metal, dannes salt og brintgas.
Alkali + Metal → Salt + Brint
Eksempler:
- Når natriumhydroxid interagerer med aluminiummetal, dannes natriumaluminat og brintgas.
2 NaOH + 2 Al + 2 H 2 O → 2 NaAlO 2 + 2 H 2
- Når natriumhydroxid interagerer med zinkmetal, producerer det hydrogengas og natriumzinkat.
2 NaOH + Zn → Na 2 ZnO 2 + H 2
- Reaktion af ikke-metalliske oxider med base: Salt og vand dannes, når ikke-metalliske oxider reagerer med en base.
Ikke-metallisk oxid + Base → Salt + Vand
Når calciumhydroxid reageres en base med kuldioxid, hvorefter der dannes calciumcarbonat og vand.
Ca(OH) 2 + CO 2 → CaCO 3 + H 2 O
- Reaktion af alkalier/base med ammoniumsalte: Ammoniak dannes, når alkalier reagerer med ammoniumsalte.
Alkali + Ammoniumsalt → Salt + Vand + Ammoniak
Når calciumhydroxid reagerer med ammoniumchlorid, dannes calciumchloridvand og ammoniak.
Ca(OH) 2 + NH 4 Cl → CaCl 2 + H 2 O + NH 3
Eksempler på baser
Baser er generelt metaloxid, metalhydroxid, metalhydrogenkarbonat, metalkarbonater osv. Lad os se nogle af eksemplerne på baser med deres anvendelse i tabelform:
| Baser | Ansøgninger |
|---|---|
| Kaliumhydroxid KOH | Anvendes i alkaliske batterier |
| Natriumhydroxid NaOH | Anvendes til fremstilling af sæbe og vaskemiddel |
| Magnesiumhydroxid Mg(OH) 2 | Anvendes som antacida |
| Natriumbicarbonat NaHCO 3 | Brugt som bagepulver |
| Natriumkarbonat Allerede 2 CO 3 | Brugt som vaskesodavand java returkommando |
| Ammoniak NH 3 | Anvendes til fremstilling af rengørings- og farmaprodukter |
| Calciumhydroxid Ca(OH) 2 | Brugt i hvidvask |
Brug af baser
Der er forskellige anvendelsestilfælde af base, nogle af disse er:
- Natriumhydroxid bruges til fremstilling af sæbe og papir. Natriumhydroxid (NaOH) bruges også til fremstilling af rayon.
- Blegepulver er lavet af Ca(OH)2, almindeligvis kendt som læsket kalk eller calciumhydroxid.
- Calciumhydroxid bruges til at skabe tørre blandinger til maling og dekoration.
- Magnesiumhydroxid, populært kendt som magnesiamælk, er et afføringsmiddel, der er meget brugt. Det bruges også som et antacidum, da det reducerer overskydende surhedsgrad i den menneskelige mave.
- I laboratorier er ammoniumhydroxid et kritisk reagens.
- Læsket kalk kan bruges til at neutralisere eventuel overskydende surhed i jorden.
Læs mere
- Syre, Base og Salt
- Syrens styrke
- Ionisering af syre og base
Ofte stillede spørgsmål om baser i kemi
1. Hvad er baser?
- Baseforbindelser har en bitter smag til dem.
- Teksturen af de fleste baser er sæbeagtig.
- Når det testes på lakmuspapir, forvandler det rødt lakmuspapir til blåt lakmuspapir i de fleste tilfælde.
- I opløsning leder basisforbindelserne også elektricitet.
- Når baseforbindelser opløses i vand, frigives OH-ioner.
2. Hvad er funktionerne af baser?
Herhjemme bruger vi baser som rengøringsmidler og antacida. Sæber, lud (som bruges i ovnrens), magnesiamælk og Tums er alle eksempler på populære hjemmelavede baser. Hver af dem har en pH større end syv, kan forbruge frit brint og neutralisere syrer.
3. Hvad er den vigtigste forskel mellem en syre og en base?
Syrer og Baser er to typer ætsende kemikalier. Sure materialer har en pH-værdi mellem 0 og 7, mens baser har en pH-værdi mellem 7 og 14. Syrer er ioniske kemikalier, der nedbrydes i vand for at danne hydrogenionen (H+), mens Base dissocierer og giver OH-ion.
4. Hvad er de fysiske egenskaber ved baser?
- De har en bitter smag til dem.
- Deres vandige opløsninger har en sæbeagtig kvalitet til dem.
- De ændrer farven på lakmuspapir fra rød til blå.
- Deres vandige opløsninger er elektrisk ledende.
- Med frigivelsen af brintgas reagerer baser med metaller for at danne salt.
5. Hvad vil der ske, når Calciumhydroxid reagerer med ammoniumchlorid?
Når calciumhydroxid reagerer med ammoniumchlorid, dannes calciumchloridvand og ammoniak.
Ca(OH) 2 + NH 4 Cl → CaCl 2 + H 2 O + NH 3
6. Hvad sker der, når natriumhydroxid reagerer med zinkmetal?
Når natriumhydroxid interagerer med zinkmetal, producerer det hydrogengas og natriumzinkat.
2 NaOH + Zn → Na 2 ZnO 2 + H 2
7. Hvad er Lewis Base?
Lewis Base er de forbindelser, der donerer et par elektroner til den elektronmangelfulde forbindelse. Eksempel inkluderer NH3.
8. Hvad er baser lavet af?
Baser består generelt af OH–ion. Bortset fra disse metaloxider er carbonater og hydrogencarbonater også baser.
9. Hvad er alkalier?
De baser, der er opløselige i vand, kaldes alkalier. Et eksempel er natriumhydroxid NaOH.
10. Hvad er stærk base og svag base?
Baserne, der dissocierer fuldstændigt for at give OH–ioner ved opløsning i vand kaldes Strong Base. Eksempler inkluderer NaOH. Svage baser er dem, der ikke dissocierer fuldstændigt for at frigøre OH–ion kaldes en svag base. Eksempler på svage baser omfatter ammoniumhydroxid.
