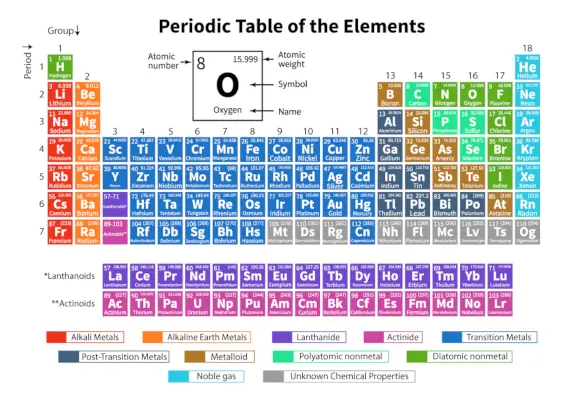
Det Periodiske system af grundstoffer er et systematisk arrangement af 118 kendte kemiske grundstoffer. Disse kemiske grundstoffer er organiseret i rækkefølge efter stigende atomnummer. De vandrette rækker fra venstre mod højre kaldes perioder, mens de lodrette kolonner fra top til bund kaldes grupper i et periodisk system.
Indholdsfortegnelse
- Hvad er det periodiske system?
- Liste over grundstoffer i det periodiske system
- Vigtige udtryk i det periodiske system
- Klassificering af grundstoffer i det periodiske system
- Mendeleev periodiske system
- Ofte stillede spørgsmål om det periodiske system
Hvad er det periodiske system?
Et periodisk system er en tabelrepræsentation, hvor alle kendte kemiske grundstoffer er arrangeret i vandrette rækker kaldet perioder og lodrette kolonner kaldet grupper baseret på deres Atom nummer henholdsvis atomstruktur.
Det er et arrangement af alle de kendte grundstoffer og giver derfor information om grundstofferne såsom deres masse, elektronnummer, elektronkonfiguration og deres unikke kemiske egenskaber.
Liste over grundstoffer i det periodiske system
Her er tabellen, der repræsenterer 118 elementer i det periodiske system. De anførte grundstoffer er arrangeret efter den stigende rækkefølge af atomnummer og deres respektive atomvægt, symbol, tæthed og elektronegativitet.
| Grundstoffer i det periodiske system med atommasse | |||||
|---|---|---|---|---|---|
| Atom nummer | Kemisk grundstofnavn | Symbol | Atommasse (amu) | Massefylde (g/cm 3 ) | Elektronegativitet |
| 1 | Brint | H | 1,0079 | 0,00008988 | 2.2 |
| 2 | Helium | Han | 4,0026 | 0,0001785 | – |
| 3 | Lithium | At | 6.941 | 0,534 | 0,98 |
| 4 | Beryllium | Være | 9,0122 | 1,85 | 1,57 |
| 5 | Bor | B | 10.811 | 2,34 | 2.04 |
| 6 | Kulstof | C | 12.0107 | 2.267 | 2,55 |
| 7 | Nitrogen | N | 14.0067 | 0,0012506 | 3.04 |
| 8 | Ilt | O | 15.9994 | 0,001429 | 3,44 |
| 9 | Fluor | F | 18.9984 | 0,001696 | 3,98 |
| 10 | Neon | Ja | 20.1797 | 0,0009002 | – |
| elleve | Natrium | Allerede | 22.9897 | 0,968 | 0,93 |
| 12 | Magnesium | Mg | 24.305 | 1.738 | 1,31 |
| 13 | Aluminium | Til | 26,9815 | 2.7 | 1,61 |
| 14 | Silicium | Ja | 28.0855 | 2.329 | 1.9 |
| femten | Fosfor | P | 30,9738 | 1.823 | 2.19 |
| 16 | Svovl | S | 32.065 | 2.07 | 2,58 |
| 17 | Klor | Cl | 35.453 | 0,0032 | 3.16 |
| 18 | Argon | Med | 39.948 | 0,001784 | – |
| 19 | Kalium | K | 39,0983 | 0,89 | 0,82 |
| tyve | Calcium | At | 40.078 | 1,55 | 1 |
| enogtyve | Scandium | Sc | 44,9559 | 2.985 | 1,36 |
| 22 | Titanium | Af | 47.867 | 4.506 | 1,54 |
| 23 | Vanadium | I | 50,9415 | 6.11 | 1,63 |
| 24 | Chrom | Cr | 51,9961 | 7.15 | 1,66 |
| 25 | Mangan | Mn | 54.938 | 7.21 | 1,55 |
| 26 | Jern | Tro | 55.845 | 7.874 | 1,83 |
| 27 | Kobolt | Co | 58,9332 | 8.9 | 1,88 |
| 28 | Nikkel | I | 58,6934 | 8.908 | 1,91 |
| 29 | Kobber | Med | 63.546 | 1.9 | 60 |
| 30 | Zink | Zn | 65,39 | 1,65 | 70 |
| 31 | Gallium | Her | 69.723 | 1,81 | 19 |
| 32 | Germanium | Ge | 72,64 | 2.01 | 1.5 |
| 33 | Arsenik | Som | 74,9216 | 2.18 | 1.8 |
| 3. 4 | Selen | HAN | 78,96 | 2,55 | 0,05 |
| 35 | Brom | Br | 79.904 | 2,96 | 2.4 |
| 36 | Krypton | Kr | 83.798 | 3 | 1×10−4 |
| 37 | Rubidium | Rb | 85,4678 | 0,82 | 90 |
| 38 | Strontium | Sr | 87,62 | 0,95 | 370 |
| 39 | Yttrium | OG | 88.906 | 1.22 | 33 |
| 40 | Zirkonium | Zr | 91.224 | 1,33 | 165 |
| 41 | Niobium | NB | 92.906 | 1.6 | tyve |
| 42 | Molybdæn | Mo | 95,94 | 2.16 | 1.2 |
| 43 | Technetium | Tc | 98 | 1.9 | ~ 3×10−9 |
| 44 | Ruthenium | Ru | 101,07 | 2.2 | 0,001 |
| Fire. Fem | Rhodium | Rh | 102,91 | 2,28 | 0,001 |
| 46 | Palladium | Pd | 106,42 | 2.2 | 0,015 |
| 47 | Sølv | På | 107,87 | 1,93 | 0,075 |
| 48 | Cadmium | Cd | 112.411 | 1,69 | 0,159 |
| 49 | Indium | I | 114,82 | 1,78 | 0,25 |
| halvtreds | Tro på | Sn | 118,71 | 1,96 | 23 |
| 51 | Antimon | Sb | 121,76 | 2,05 | 0,2 |
| 52 | Tellur | Det | 127,6 | 2.1 | 0,001 |
| 53 | Jod | jeg | 126,9045 | 2,66 | 0,45 |
| 54 | Xenon | Bil | 131.293 | 2.6 | 3×10−5 |
| 55 | Cæsium | Cs | 132,91 | 0,79 | 3 |
| 56 | Barium | Ikke | 137.327 | 0,89 | 425 |
| 57 | Lanthanum | Det | 138,91 | 1.1 | 39 |
| 58 | Cerium | Det her | 140,12 | 1.12 | 66,5 |
| 59 | Praseodymium | Pr | 140,9077 | 1.13 | 9.2 |
| 60 | Neodym | Nd | 144,24 | 1.14 | 41,5 |
| 61 | Promethium | Om eftermiddagen | 145 | 1.13 | 2×10−19 |
| 62 | Samarium | Sm | 150,36 | 1.17 | 7.05 |
| 63 | Europium | Eu | 151.964 | 1.2 | 2 |
| 64 | Gadolinium | Gd | 157,25 | 1.2 | 6.2 |
| 65 | Terbium | Tb | 158,9253 | 1.2 | 1.2 |
| 66 | Dysprosium | De der | 162,5 | 1.22 | 5.2 |
| 67 | Holmium | Til | 164,9303 | 1,23 | 1.3 |
| 68 | Erbium | Er | 167.259 | 1,24 | 3.5 |
| 69 | Thulium | Tm | 168,9342 | 1,25 | 0,52 |
| 70 | Ytterbium | Yb | 173,04 | 1.1 | 3.2 |
| 71 | Paris | Lu | 174.967 | 1,27 | 0,8 |
| 72 | Hafnium | Hf | 178,49 | 1.3 | 3 |
| 73 | Tantal | Over | 180,9479 | 1.5 | 2 |
| 74 | Wolfram | I | 183,84 | 2,36 | 1.3 |
| 75 | Rhenium | Vedr | 186.207 | 1.9 | 7×10−4 |
| 76 | Osmium | Du | 190,23 | 2.2 | 0,002 |
| 77 | Iridium | Og | 192,22 | 2.2 | 0,001 |
| 78 | Platin | Pt | 195,08 | 2,28 | 0,005 |
| 79 | Guld | På | 196,97 | 2,54 | 0,004 |
| 80 | Merkur | Hg | 200,59 | 2 | 0,085 |
| 81 | Thallium | Tl | 204,3833 | 1,62 | 0,85 |
| 82 | At føre | Pb | 207,2 | 1,87 (2+) 2,33 (4+) | 14 |
| 83 | Bismuth | Med en | 208,9804 | 2.02 | 0,009 |
| 84 | Polonium | Efter | 209 | 2 | 2×10−10 |
| 85 | Astatin | På | 210 | 2.2 | 3×10−20 |
| 86 | Radon | Rn | 222 | 2.2 | 4×10−13 |
| 87 | Francium | Fr | 223 | >0,79[6] | ~ 1×10−18 |
| 88 | Radium | Sol | 226 | 0,9 | 9×10−7 |
| 89 | Actinium | Og | 227 | 1.1 | 5,5×10−10 |
| 90 | Thorium | Th | 232,0381 | 1.3 | 9.6 |
| 91 | Protactinium | Godt | 231,0359 | 1.5 | 1,4×10−6 |
| 92 | Uran | I | 238,0289 | 1,38 | 2.7 |
| 93 | Neptun | F.eks | 237 | 1,36 | ≤ 3×10−12 |
| 94 | Plutonium | kunne | 244 | 1,28 | ≤ 3×10−11 |
| 95 | Americium | Er | 243 | 1.13 | – |
| 96 | Curium | Cm | 247 | 1,28 | – |
| 97 | Berkelium | Bk | 247 | 1.3 | – |
| 98 | Californien | Jf | 251 | 1.3 | – |
| 99 | Einsteinium | Er | 252 | 1.3 | – |
| 100 | Fermium | Fm | 257 | 1.3 | – |
| 101 | Mendeleev | Md | 258 | 1.3 | – |
| 102 | adelig | Ingen | 259 | 1.3 | – |
| 103 | Lawrencium | Lr | 262 | 1.3 | – |
| 104 | Rutherfordium | Rf | 267 | – | – |
| 105 | Dubnium | Db | 268 | – | – |
| 106 | Seaborgium | Sg | 269 | – | – |
| 107 | Bohrium | Bh | 270 | – | – |
| 108 | Hassium | Hs | 269 | – | – |
| 109 | Meitnerium | Mt | 277 | – | – |
| 110 | Darmstadtium | Ds | 281 | – | – |
| 111 | Røntgenium | Rg | 282 | – | – |
| 112 | Copernicus | Cn | 285 | – | – |
| 113 | Nihonium | Nh | 286 | – | – |
| 114 | Flerovium | I | 290 | – | – |
| 115 | Moscovium | Mc | 290 | – | – |
| 116 | Livermorium | Lv | 293 | – | – |
| 117 | Tennessine | Ts | 294 | – | – |
| 118 | Oganesson | Og | 294 | – | – |
Vigtige udtryk i det periodiske system
| Betingelser java8 funktioner | Beskrivelse |
|---|---|
| Atom nummer | Antallet af protoner, der udgør et grundstofs kerne, kaldes dets atomnummer (Z). f.eks. Kulstof indeholder da 6 protoner, så dets atomnummer må kun være 6. |
| Atommasse | Det er defineret som den gennemsnitlige masse af et grundstofs atomer. Det måles på grundlag af den relative naturlige forekomst af grundstoffets isotoper. Atommasse kaldes også Atomvægt (A). Det måles i atommasseenheden (amu). |
| Periode | De vandrette rækker fra venstre mod højre i et periodisk system kaldes perioder. Der er i alt 7 perioder i det periodiske system. Grundstofferne er arrangeret vandret på grund af deres ligheder i egenskaber, som de samme atomare orbitaler og så videre. |
| Gruppe | De lodrette kolonner fra top til bund i et periodisk system kaldes grupper. Der er i alt 18 grupper i det periodiske system. Grundstofferne er arrangeret lodret på grund af deres ligheder i egenskaber, da de har det samme antal valenselektroner i sig. |
| Symbol på et element | Et symbol er et begreb, der bruges til at repræsentere et kemisk grundstof ved hjælp af et bogstav eller en kombination af to til tre bogstaver. f.eks. Det kemiske symbol for kulstof er C, mens Fe bruges til jern og så videre. |
Klassificering af grundstoffer i det periodiske system
De 118 elementer er arrangeret i 7 perioder og 18 grupper som vist ovenfor. Yderligere er elementerne opdelt i forskellige blokke.
| Blok | Elementer inkluderet | Sidste Electron Subshell fyldt |
|---|---|---|
| s-blok | Gruppe 1 (alkalimetaller) | s-subshell |
| Gruppe 2 (jordalkalimetaller) | ||
| p-blok | Gruppe 13 (Boron Family) | p-subshell |
| Gruppe 14 (kulstoffamilie) | ||
| Gruppe 15 (nitrogenfamilie) | ||
| Gruppe 16 (iltfamilie) | ||
| Gruppe 17 (Fluorfamilie) | ||
| d-blok | Gruppe 3 til 12 (overgangselementer) | d-subshell |
| f-blok | Lanthanider (sjældne jordarter) | f-subshell |
| Aktinider |
Mendeleev periodiske system
For at repræsentere ligheder og tendenser i grundstoffernes adfærd udviklede Mendeleev det periodiske system, som er et arrangement af grundstoffer i en stigende atommasserækkefølge i tabelform.

Ifølge Mendeleevs periodiske system blev grundstoffer arrangeret efter deres grundlæggende egenskaber, atommasse og kemiske egenskaber. Kun 63 elementer var kendt på tidspunktet for Mendeleevs arbejde. I Mendeleevs periodiske system blev den vandrette række og lodrette kolonner omtalt som henholdsvis grupper og perioder.
Men Mendeleevs periodiske system fejler på grund af mange fejl i det. Nogle af dem er, at det undlod at udpege brint og ædelgasser i det. Desuden var den stigende rækkefølge af grundstoffernes atommasse ikke regelmæssig i hele tabellen. Selv opdagelsen af isotoper overtræder Mendeleevs periodiske lov.
Læs mere:
- Det moderne periodiske system
- Mendeleev periodiske tabel
- Moderne periodisk lov
- Det periodiske systems historie
- Atomstruktur
Ofte stillede spørgsmål om det periodiske system
Hvad er grundstoffernes periodiske system?
Grundstoffernes periodiske system er et tabelarrangement af kemiske grundstoffer organiseret efter deres atomnummer, elektronkonfiguration og tilbagevendende kemiske egenskaber. Tabellen er opdelt i rækker kaldet perioder og kolonner kaldet grupper eller familier.
Hvem opdagede grundstoffernes periodiske system?
Det periodiske system af grundstoffer blev ikke opdaget af en enkelt person, men dets udvikling er krediteret Dmitri Mendeleev, en russisk kemiker, som arrangerede grundstoffer baseret på deres egenskaber i 1869.
Hvem lavede det moderne periodiske system?
I 1913 introducerede Henry Moseley en opdateret version af det periodiske system, almindeligvis omtalt som det moderne periodiske system.
Hvordan er det periodiske system opstillet?
Det periodiske system er arrangeret i rækkefølge efter stigende atomnummer, med elementer grupperet sammen baseret på lignende kemiske egenskaber og arrangeret i perioder (rækker) og grupper (søjler).
Hvad er atomnummer?
Antallet af protoner, der udgør et grundstofs kerne, kaldes dets atomnummer (Z). f.eks. Kulstof indeholder 6 protoner, dets atomnummer må kun være 6.
Kan to forskellige grundstoffer have samme atomnummer?
Antallet af neutroner i et atom fra to forskellige grundstoffer kan være ens, men antallet af protoner vil aldrig være det samme. Hvert grundstof har et bestemt antal protoner, som svarer til antallet af atomer.
Hvordan beregner man atommasse?
Atommassen kan beregnes ved at tilføje massen af protoner og neutroner i et grundstof.
Hvad er en gruppe i det periodiske system?
Kolonnen i det periodiske system refererer til gruppen af det periodiske system. Grundstofferne i samme gruppe har lignende fysiske og kemiske egenskaber.
